- Centro de informaciónHalógeno SensiCLĒNE™ El MP5™ se creó con las calibraciones estables y el bajo mantenimiento como requisitos prioritarios. Para ello,...Real Talk about "Continuous Monitoring" Chlorine Analyzer claims Some manufacturers of online chlorine analyzers are making bold claims...
- Industrias y aplicacionesMarítimo y aviación
Agua potable
Control de aeropuertos y aviones
Control de las fuentes de entrada
Control de camiones cisterna
INDUSTRIALTransformación industrial
- ProductosHalógeno SensiCLĒNE™ El MP5™ fue creado con calibraciones estables y...Real Talk about "Continuous Monitoring" Chlorine Analyzer claims Algunos fabricantes...
- Contacte con
ORP frente a sensores amperométricos
Potencial de Oxidación-Reducción
Hay dos métodos disponibles para la medición del oxidante residual total (TRO): un sensor de potencial de reducción de oxidación (ORP) o un sensor amperométrico. Hasta ahora, no ha habido sensores amperométricos que hayan sido prácticos en una aplicación de agua de lastre. En este artículo se examinan las ventajas y limitaciones relativas de ambos métodos.
La medición del redox es el método menos costoso disponible para el control del agua. Se utiliza principalmente en la industria de las piscinas, así como en algunas aplicaciones especializadas, como la destrucción del cianuro (industrias de revestimiento y mineras). Se utiliza con frecuencia como indicador cualitativo. En las piscinas comerciales, cuando se utiliza para controlar el equipo de alimentación de cloro, la mayoría de los operadores suelen medir el nivel de cloro manualmente, a menudo a diario. La presencia de altos niveles de moléculas orgánicas puede ensuciar el sensor en cuestión de días, requiriendo su limpieza.
"Halogen Systems incluyó la medición de ORP en su sensor multiparamétrico como indicador de contaminación... La técnica de medición y la tecnología de autolimpieza de HSI eliminan los problemas de envenenamiento, proporcionando una lectura más fiable."
Halogen Systems incluyó una medición de ORP de respuesta rápida en su sensor multiparamétrico como indicador de contaminación. Aunque la medición de cloro del sensor puede detectar cloro de 0,05 a 15 ppm, no puede detectar la diferencia entre contaminación y agua en la que el cloro residual se ha agotado recientemente. El ORP puede llenar potencialmente este vacío identificando un caso de contaminación o una conexión cruzada al indicar una caída por debajo del nivel de ORP de referencia. Además, la técnica de medición de HSI y el sistema de autolimpieza eliminan los problemas de envenenamiento, proporcionando una lectura más fiable. Aunque la medición de ORP de HSI puede tener un ligero desfase con respecto a otros sensores, proporciona una medición fiable y cualitativa que supera muchos de los problemas de ORP.
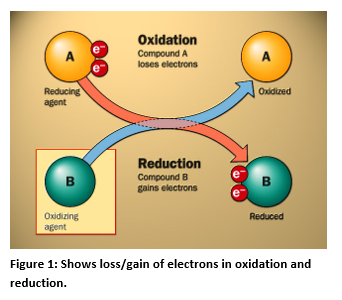
La medición del ORP
Un sensor de ORP consta de un electrodo de ORP y un electrodo de referencia, ya que un voltímetro mide la diferencia de potencial (tensión). El principio en el que se basa la medición de ORP es el uso de un electrodo de metal inerte (platino, a veces oro), que, debido a su baja resistencia, cederá electrones a un oxidante (cloro en este caso) o aceptará electrones de un reductor (dióxido de azufre en un proceso de decloración) . El electrodo de ORP continuará aceptando o cediendo electrones hasta que desarrolle un potencial, debido a la carga acumulada, que sea igual al ORP de la solución. La precisión típica de una medición de ORP es de ±5 mV. Esto se complica aún más por el hecho de que diferentes sondas del mismo fabricante a menudo tendrán una diferencia de 20 a 50 mV en la misma muestra de agua. Nota: los fabricantes prueban sus sensores en solución Zobell, que contiene un alto nivel de pares redox. En esta solución, los sensores darán lecturas muy próximas entre sí. Este no es el caso de las muestras reales de agua potable.
ORP por definición
ORP significa potencial de oxidación-reducción, que es una medida, en milivoltios, de la tendencia de una sustancia química a oxidar o reducir otra sustancia química. La oxidación es la pérdida de electrones por parte de un átomo, molécula o ion. Los electrones perdidos por el átomo en la reacción no pueden existir en solución y tienen que ser aceptados por otra sustancia en solución. Por lo tanto, la reacción completa de oxidación deberá incluir otra sustancia, que se reducirá.
Los electrodos Redox se envenenan fácilmente
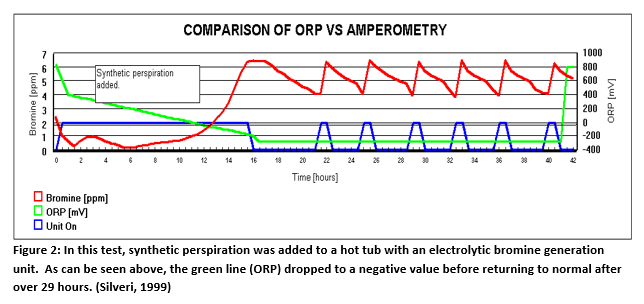
La Figura 2 (abajo) ilustra los resultados de un experimento en un spa de 300 galones utilizando bromo como desinfectante. Se instaló un sensor de ORP como monitor (no controlador). También se instaló un generador de bromo con un sensor amperométrico para controlar el nivel de desinfectante. A continuación, se añadió transpiración sintética al spa. La línea roja es el nivel de bromo que el sistema amperométrico midió durante toda la prueba. Los picos de la línea azul representan el tiempo durante el cual el generador de bromo se activó para satisfacer la demanda. La transpiración sintética (White, 1992) creó una demanda significativa que persistió durante toda la prueba, requiriendo que el generador de bromo funcionara durante unas dos horas seguidas. Después de unas 12 horas, el sensor de ORP, representado por la línea verde, registró valores negativos. La causa más probable fue el envenenamiento del electrodo. No se recuperó durante 29 horas. Esto habría causado una sobrecloración o sobrebromación masiva del spa, si hubiera estado controlando el desinfectante.
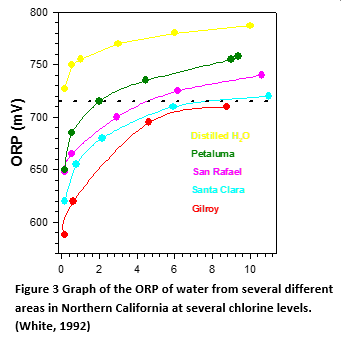
El nivel de referencia (sin cloro) varía en función del agua
Como puede observarse en el gráfico de la figura 3, cinco muestras de agua diferentes tienen una línea de base de ORP diferente que da como resultado un ORP más alto para el mismo nivel de cloro. Los resultados varían en casi 200 mV. Según la OMS, "existe una amplia variación entre 720 mV en diferentes aguas (de 1 ppm a 15 ppm de cloro) debido a la variación de la línea base de ORP (cloro cero)" (Organización Mundial de la Salud, 2006) Con los sensores amperométricos, la corriente cero es siempre cloro cero, por lo que no se necesita calibración cero. Debe tenerse en cuenta que esta comparación se realizó con agua del grifo. El ORP de referencia del agua de mar puede oscilar entre -275 y 350 mV, lo que agrava enormemente el problema de la línea de base (Cohrs, 2004). (Cohrs, 2004) El menor potencial de oxidación del bromo en comparación con el cloro significa que el ORP no será tan sensible a la concentración como lo será con el cloro. Esto también significa que el potencial de un sensor de ORP estará más cerca del nivel de referencia (nivel cero de bromo).
Medición de la concentración con ORP
A continuación se enumeran las limitaciones del uso del ORP para la medición de la concentración de cloro:
- Según la ecuación de Nernst que rige la relación del ORP con la medición del potencial, el coeficiente que multiplica este logaritmo de la concentración es igual a -59,16 mV, dividido por el número de electrones en la semirreacción (n). En este caso, n = 2; por lo tanto, el coeficiente es -29,58. Un cambio de 10 veces en la concentración de Cl-, HOCl, H+ sólo cambiará el ORP ±29,58 mV. (Emerson Process Liquid Division, 2008)
- El ORP depende del ion cloruro (Cl-) y del pH (H+) tanto como del ácido hipocloroso (cloro en el agua). Cualquier cambio en la concentración de cloruro o en el pH afectará al ORP. Por lo tanto, para medir el cloro con precisión, el ion cloruro y el pH deben medirse con gran exactitud o controlarse cuidadosamente hasta alcanzar valores constantes.
- Para calcular la concentración de hipoclorito a partir de los milivoltios medidos, los milivoltios medidos aparecerán como el exponente de 10. La precisión típica de una medición de ORP es de ±5 mV. Este error por sí solo hará que la concentración de ácido hipocloroso calculada se desvíe en más de ±30%. Cualquier deriva en el electrodo de referencia o en el analizador de ORP sólo aumentará este error.
- Cualquier cambio en el ORP con la temperatura no se compensa, aumentando aún más el error en la concentración derivada.
- Prácticamente todas las semirreacciones de redox implican a más de una sustancia, y la gran mayoría dependen del pH. La dependencia logarítmica del ORP con respecto a la concentración multiplica cualquier error en los milivoltios medidos.
- Los electrodos de ORP se envenenan fácilmente y quedan inutilizados durante horas, a menos que se retiren y se limpien.
- El uso de ORP en la electrocloración del agua de mar sólo amplifica la mayoría de los problemas inherentes
- La calibración a cero con ORP es difícil ya que diferentes aguas o contaminantes cambian la línea de base. En el agua de mar, la línea de base puede oscilar entre -275 y 350 mV.
Conclusiones: Basándonos en los puntos anteriores el ORP no es una buena técnica para aplicar a las medidas de concentración
Amperometría
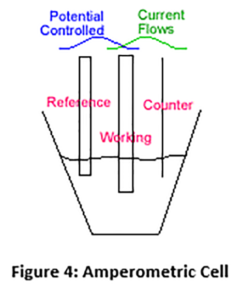
En un sensor amperométrico, se aplica un voltaje fijo entre dos electrodos y se produce una reacción en el electrodo de trabajo (cátodo) en la que el cloro se reduce de cloro (HOCl) a cloruro (Cl-) Figura 4 (Abajo).
Esto es lo contrario de lo que ocurre en el generador de cloro, donde el cloro se genera en el ánodo. En un sensor amperométrico, la corriente que fluye como resultado de esta reducción es proporcional al cloro que se presenta al sensor. La figura anterior muestra la configuración de "tres electrodos". La mayoría de los sensores de cloro de membrana utilizan el método de "dos electrodos". En general, las lecturas del método de dos electrodos no son tan estables y los electrodos no duran tanto como los del método de tres electrodos.
Cuando se añade cloro al agua, se hidroliza para formar: Suele ser el ácido hipocloroso (HOCl) el que se mide con el sensor amperométrico de membrana.
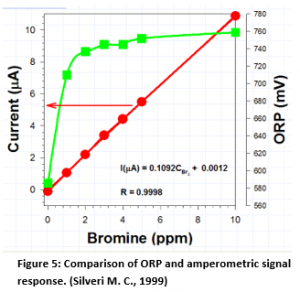
Relación entre señal logarítmica y lineal
Como puede verse en la Figura 5, en los sistemas amperométricos, la relación con el cloro (o bromo) es lineal frente a la relación logarítmica
para ORP. Cualquier intento de controlar el bromo entre 2 y 4 ppm no dará como resultado un control muy estricto, ya que la resolución es muy pobre en ese rango cuando el bromo es el oxidante.
Resumen
Las limitaciones de la utilización del ORP para la medición de la concentración de cloro son:
- En los sistemas amperométricos, la relación con el cloro (o el bromo) es lineal frente a la logarítmica del ORP. El ORP no será preciso, requerirá una mayor formación, monitorización y podría dar lugar a una corrosión excesiva de los componentes o tanques, lo que a menudo anula el propósito o su uso en primer lugar.
- Los sistemas amperométricos miden realmente el bromo (TRO) y no otro parámetro (redox), por lo que serán más precisos.
- El cloro cero es siempre cero, por lo que no es necesario calibrar el cero con los sistemas amperométricos.
- Los electrodos de los sistemas amperométricos no se envenenan fácilmente con sustancias orgánicas como los electrodos de ORP.
- El ORP es a la vez un buen indicador cualitativo y un mal método cuantitativo.
Conclusiones sobre la PRL
Todas las desventajas del ORP están relacionadas con el mantenimiento rutinario del equipo, la calibración, el envenenamiento del electrodo, la presencia de múltiples parejas redox y corrientes de intercambio muy pequeñas que están logarítmicamente relacionadas con la concentración del analito. En otras palabras, la suposición de un equilibrio químico reversible, una cinética rápida del electrodo y la ausencia de reacciones de interferencia son esenciales para la interpretación química de los potenciales de redox. Por desgracia, estas condiciones rara vez, o nunca, se cumplen en los sistemas del mundo real (Kissinger, 1996). El potencial Redox puede utilizarse para el análisis cualitativo.
Referencias:
Battelle. (2004). Long-Term Deployment of Multi-Parameter Water Quality Probes/Sondes. Washington, DC: Agencia de Protección Ambiental de los Estados Unidos.
Cohrs, D. (2004). Las propiedades y la composición del agua de mar: Una visión general "elemental". 1st International Symposium of Water Systems in Aquaria and Zoological Parks, (p. 23). Lisboa, Portugal.
Damon S. Williams Associates, LLC. (2004). MONITORIZACIÓN EN LÍNEA DE LA CLORACIÓN DE EFLUENTES DE AGUAS RESIDUALES UTILIZANDO EL POTENCIAL DE REDUCCIÓN DE LA OXIDACIÓN (ORP) FRENTE A LA MEDICIÓN DEL CLORO RESIDUAL. MEDICIÓN DEL CLORO RESIDUAL. Alexandria, VA: Water Environment Research Foundation WERF.
(1991-1992). "Series electroquímicas" y "Elementos en el agua de mar". En P. David R. Lide, CRC Handbook of Chemistry and Physics 72nd Edition (pp. 8-17; 14-10). New York: CRC Press.
División de líquidos de proceso de Emerson. (2008, Mayo Desconocido). Fundamentals of ORP Measurement. Recuperado el 28 de febrero de 2011, de emersonprocess.com: www2.emersonprocess.com/siteadmincenter/.../Liq_ADS_43-014.pdf
Instrument Testing Assocation. (1990). Residual Chlorine Analyzers for Water and Wastewater Treatment Applications. Henderson, NV : Instrument Testing Assocation.
Asociación de Pruebas de Instrumentos. (1995). Analizadores de cloro total y libre residual en línea: Maintenance Benchmarking Study. Hendersen, NV: Instrument Testing Association.
Organización Internacional de Normalización. (2003). ISO15839 Water Quality- On-line Sensors/analysing equipment for water- Specifications and Performance Tests. Ginebra, Suiza: ISO.
Normas internacionales ISO. (2003). ISO15839 Water quality- On-line sensors/analysing equipment for water-Specifications and performance tests. Ginebra, Suiza: ISO.
J, M. (2006). The Chemistry of Gold Extraction, 2ª edición. Iain House, publicado por SME.
Kemmer, F. (1988). Nalco Water Handbook, 2nd ed. Nueva York, NY: McGraw-Hill, Inc.
Kissinger, P. (1996). Laboratory Techniques in Electroanalytical Chemistry2nd Ed. New York: Marcel Decker.
McPherson, L. (2002, primavera). Understanding Oxidation Reduction Potential (ORP) Systems. Extraído de Walchem Corporation.
Panguluri, S. G. (2009). MONITORIZACIÓN DE LA CALIDAD DEL AGUA DEL SISTEMA DE DISTRIBUCIÓN: METODOLOGÍA Y RESULTADOS DE LA EVALUACIÓN DE LA TECNOLOGÍA DE SENSORES. Washington, DC: U.S. ENVIRONMENTAL PROTECTION AGENCY .
Piela, B. P. (2003). Comportamiento electroquímico de las cloraminas en los electrodos giratorios de platino y oro. Journal of the Electrochemical Society, E255- E265.
Norma SAMA PMC 31.1. (1980). Generic Test Methods for the Testing and Evaluation of Process Measurement and Control Instrumentation. Williamsbury, VA: Measurement Control & Automation Association.
Silveri, M. C. (1999). On-Line 'Reagentless' Amperometric Method for Determination of Bromine in Spas. Proceedings of the 4th Annual Chemistry Symposium National Spa and Pool Institute (pp. 37-43). Las Vegas, NV: National Swimming Pool Institute.
Silveri, M. C. (2001, 7 de agosto). Patente nº 6270680B1. ESTADOS UNIDOS.
Asociación de Medición, Control y Automatización, 1980. (1980). Generic Test Methods for the Testing and Evaluation of Process Measurement and Control Instrumentation. Asociación de Medición, Control y Automatización.
Wegand, J., Lucas, K., Jackovic, T., & Slebodnick, P. a. (2001). Submarine Biofouling Control- Chlorination DATS Study at Pearl Harbor", número de informe: A565293. Washington DC: Naval Research Lab.
White, G. C. (1992). The Handbook of Chlorination and Alternative Disinfectants, 3ª edición. Van Nostrand Reinhold.
Organización Mundial de la Salud. (2006). Directrices para la seguridad de los entornos acuáticos recreativos. Volumen 2. Nueva York, NY: Organización Mundial de la Salud.