- Info-CenterHalogen MP5 präziser als Hach CL10 - San Jose Water Der Bericht Details Hintergrund San Jose Water...Halogen SensiCLĒNE™ Bei der Entwicklung des MP5™ standen stabile Kalibrierungen und geringer Wartungsaufwand im Vordergrund. Zu diesem Zweck wurde die...
- Branchen und AnwendungenSchifffahrt und Luftfahrt
Trinkbares Wasser
Flughafen & AirPLane Monitoring
Überwachung der Zuflussquelle
Tanker-Überwachung
INDUSTRIEIndustrielle Verarbeitung
Anwendungen - ProdukteHalogen SensiCLĒNE™ Das MP5™ wurde mit stabilen Kalibrierungen und...Echtes Gespräch über Behauptungen über "kontinuierliche Überwachung" von Chloranalysatoren Einige Hersteller...
- Kontakt
ORP vs. Amperometrische Sensoren
Oxidations-Reduktions-Potential
Es gibt zwei Methoden zur Messung des Gesamtrückstands an Oxidationsmitteln (TRO): einen Sensor für das Oxidationsreduktionspotenzial (ORP) oder einen amperometrischen Sensor. Bis jetzt gab es keine amperometrischen Sensoren, die in einer Ballastwasseranwendung praktikabel waren. In diesem Beitrag werden die relativen Vorteile und Grenzen beider Methoden untersucht.
Die ORP-Messung ist die kostengünstigste Methode zur Wasserüberwachung. Sie wird hauptsächlich in der Schwimmbadindustrie sowie in einigen Nischenanwendungen wie der Zyanidvernichtung (Galvanik- und Bergbauindustrie) eingesetzt. Sie wird häufig als qualitativer Indikator verwendet. In kommerziellen Schwimmbädern, die zur Steuerung der Chlordosieranlagen verwendet werden, messen die meisten Betreiber den Chlorgehalt häufig manuell, oft täglich. Das Vorhandensein hoher Mengen organischer Moleküle kann den Sensor innerhalb weniger Tage verschmutzen und eine Reinigung erforderlich machen.
"Halogen Systems hat die ORP-Messung als Indikator für Verunreinigungen in seinen Multiparameter-Sensor aufgenommen... Die Messtechnik und die Selbstreinigungstechnologie von HSI beseitigen Probleme mit Vergiftungen und liefern zuverlässigere Messwerte."
Halogen Systems hat in seinen Multiparametersensor eine ORP-Schnellmessung als Indikator für Verunreinigungen integriert. Während die Chlormessung des Sensors Chlor in einem Bereich von 0,05 bis 15 ppm nachweisen kann, ist es nicht möglich, den Unterschied zwischen einer Verunreinigung und Wasser zu erkennen, in dem der Chlorrest vor kurzem abgebaut wurde. Das ORP kann diese Lücke potenziell schließen, indem es ein Kontaminationsereignis oder eine Querverbindung identifiziert, indem es einen Abfall unter den ORP-Grundwert anzeigt. Darüber hinaus werden durch die Messtechnik und das Selbstreinigungssystem von HSI Vergiftungserscheinungen vermieden, so dass ein zuverlässigeres Ergebnis erzielt wird. Die ORP-Messung von HSI kann zwar eine leichte Abweichung von anderen Sensoren aufweisen, bietet aber eine zuverlässige, qualitative Messung, die viele ORP-Probleme überwindet.
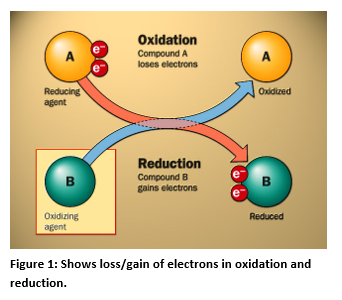
Die Messung des Redoxpotentials
Ein ORP-Sensor besteht aus einer ORP-Elektrode und einer Referenzelektrode, während ein Voltmeter die Potentialdifferenz (Spannung) misst. Das Prinzip der ORP-Messung besteht in der Verwendung einer inerten Metallelektrode (Platin, manchmal Gold), die aufgrund ihres geringen Widerstands Elektronen an ein Oxidationsmittel (in diesem Fall Chlor) abgibt oder Elektronen von einem Reduktionsmittel (Schwefeldioxid in einem Dechlorierungsprozess) aufnimmt. Die ORP-Elektrode nimmt so lange Elektronen auf oder ab, bis sie aufgrund der sich aufbauenden Ladung ein Potenzial entwickelt, das dem ORP der Lösung entspricht. Die typische Genauigkeit einer ORP-Messung beträgt ±5 mV. Dies wird noch dadurch erschwert, dass verschiedene Sonden desselben Herstellers in ein und derselben Wasserprobe oft einen Unterschied von 20 bis 50 mV aufweisen. Hinweis: Die Hersteller testen ihre Sensoren in Zobell-Lösung, die einen hohen Anteil an Redoxpaaren enthält. In dieser Lösung zeigen die Sensoren sehr nahe beieinander liegende Werte an. Das ist bei realen Trinkwasserproben nicht der Fall.
ORP nach Definition
ORP steht für Oxidations-Reduktions-Potenzial und ist ein Maß für die Tendenz einer chemischen Substanz, eine andere chemische Substanz zu oxidieren oder zu reduzieren, ausgedrückt in Millivolt. Oxidation ist der Verlust von Elektronen durch ein Atom, Molekül oder Ion. Die Elektronen, die das Atom bei der Reaktion verliert, können nicht in Lösung bleiben und müssen von einem anderen Stoff in Lösung aufgenommen werden. Die vollständige Reaktion, die die Oxidation beinhaltet, muss also eine andere Substanz einschließen, die reduziert wird.
ORP-Elektroden können leicht vergiftet werden
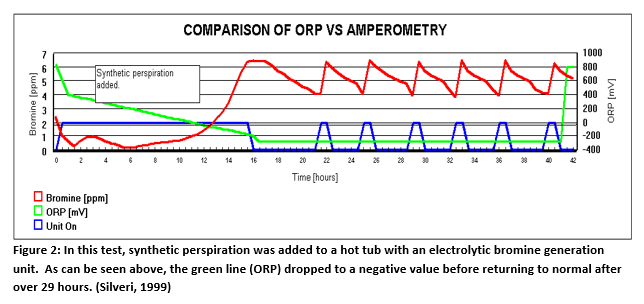
Abbildung 2 (unten) zeigt die Ergebnisse eines Experiments in einem 300-Gallonen-Whirlpool mit Brom als Desinfektionsmittel. Ein ORP-Sensor wurde zur Überwachung (nicht zur Steuerung) installiert. Ein Bromgenerator mit einem amperometrischen Sensor wurde ebenfalls installiert, um den Desinfektionsmittelgehalt zu kontrollieren. Anschließend wurde dem Whirlpool synthetischer Schweiß zugeführt. Die rote Linie ist der Bromgehalt, den das amperometrische System während des Tests gemessen hat. Die Spitzen in der blauen Linie stellen die Zeit dar, in der der Bromgenerator eingeschaltet war, um den Bedarf zu decken. Die synthetische Transpiration (White, 1992) erzeugte einen erheblichen Bedarf, der während des gesamten Tests anhielt, so dass der Bromgenerator etwa zwei Stunden am Stück arbeiten musste. Nach etwa 12 Stunden registrierte der ORP-Sensor, dargestellt durch die grüne Linie, negative Werte. Die wahrscheinlichste Ursache war eine Vergiftung der Elektrode. Sie erholte sich 29 Stunden lang nicht von diesem Zustand. Dies hätte zu einer massiven Überchlorung oder Überbromung des Whirlpools geführt, wenn sie das Desinfektionsmittel gesteuert hätte.
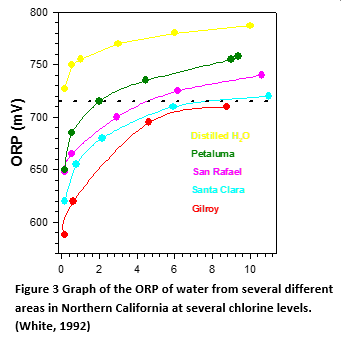
Der Basiswert (Null-Chlor) variiert je nach Wasserart
Wie aus dem Diagramm in Abbildung 3 ersichtlich ist, haben fünf verschiedene Wasserproben eine unterschiedliche ORP-Basislinie, die bei gleichem Chlorgehalt zu einem höheren ORP führt. Die Ergebnisse variieren um fast 200 mV. Laut WHO "gibt es eine große Variation zwischen 720 mV in verschiedenen Wässern (1 ppm bis 15 ppm Chlor) aufgrund der unterschiedlichen ORP-Basislinie (Null-Chlor)" (Weltgesundheitsorganisation, 2006) Bei amperometrischen Sensoren ist der Nullstrom immer Null-Chlor, so dass keine Null-Kalibrierung erforderlich ist. Es ist zu beachten, dass dieser Vergleich mit Leitungswasser durchgeführt wurde. Das Basis-Redoxpotential von Meerwasser kann zwischen -275 und 350 mV liegen, was das Problem der Basislinie erheblich verschärft. (Cohrs, 2004) Das niedrigere Oxidationspotenzial von Brom im Vergleich zu Chlor bedeutet, dass das ORP nicht so empfindlich auf die Konzentration reagiert wie bei Chlor. Dies bedeutet auch, dass das Potenzial eines ORP-Sensors näher an der Basislinie liegt (Null-Brom-Gehalt).
Konzentrationsmessung mit ORP
Die Einschränkungen bei der Verwendung von ORP für die Messung der Chlorkonzentration sind im Folgenden aufgeführt:
- Nach der Nernst-Gleichung, die das Verhältnis zwischen dem Redoxpotential und der Potentialmessung regelt, ist der Koeffizient, der diesen Logarithmus der Konzentration multipliziert, gleich -59,16 mV, geteilt durch die Anzahl der Elektronen in der Halbreaktion (n). In diesem Fall ist n = 2; der Koeffizient beträgt also -29,58. Eine 10-fache Änderung der Konzentration von Cl-, HOCl, H+ wird das ORP nur um ±29,58 mV ändern. (Emerson Process Liquid Division, 2008)
- Das ORP hängt vom Chlorid-Ion (Cl-) und dem pH-Wert (H+) ebenso ab wie von der unterchlorigen Säure (Chlor im Wasser). Jede Änderung der Chloridkonzentration oder des pH-Werts wirkt sich auf das ORP aus. Um Chlor genau zu messen, müssen daher Chloridionen und pH-Wert mit hoher Genauigkeit gemessen oder sorgfältig auf konstante Werte geregelt werden.
- Zur Berechnung der Hypochlorkonzentration aus den gemessenen Millivoltwerten erscheinen die gemessenen Millivoltwerte als Exponent von 10. Die typische Genauigkeit einer ORP-Messung beträgt ±5 mV. Allein dieser Fehler führt dazu, dass die berechnete unterchlorige Säurekonzentration um mehr als ±30 % daneben liegt. Jegliche Drift der Referenzelektrode oder des ORP-Analysegeräts erhöht diesen Fehler nur noch weiter.
- Jede Veränderung des Redoxpotentials mit der Temperatur wird nicht kompensiert, was den Fehler in der abgeleiteten Konzentration weiter erhöht.
- An praktisch allen ORP-Halbwertreaktionen ist mehr als eine Substanz beteiligt, und die große Mehrheit ist pH-abhängig. Die logarithmische Abhängigkeit des ORP von der Konzentration vervielfacht etwaige Fehler in den gemessenen Millivolt.
- ORP-Elektroden können leicht vergiftet werden und sind dann stundenlang unbrauchbar, wenn sie nicht entfernt und gereinigt werden.
- Die Verwendung von ORP bei der Elektrochlorierung von Meerwasser vergrößert nur die meisten der damit verbundenen Probleme
- Die Nullkalibrierung mit ORP ist schwierig, da unterschiedliche Wässer oder Verunreinigungen die Basislinie verändern. In Meerwasser kann die Basislinie von -275 bis 350 mV reichen.
Schlussfolgerung: Aufgrund der vorstehenden Punkte ist das ORP-Verfahren für Konzentrationsmessungen nicht geeignet.
Amperometrie
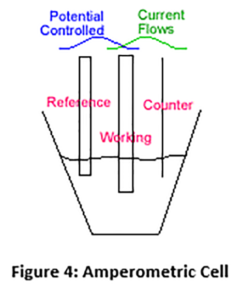
Bei einem amperometrischen Sensor wird eine feste Spannung zwischen zwei Elektroden angelegt, und an der Arbeitselektrode (Kathode) findet eine Reaktion statt, bei der Chlor von Chlor (HOCl) zurück zu Chlorid (Cl-) reduziert wird (siehe Abbildung 4 unten).
Dies geschieht in umgekehrter Weise wie im Chlorgenerator, wo Chlor an der Anode erzeugt wird. In einem amperometrischen Sensor ist der Strom, der infolge dieser Reduktion fließt, proportional zu dem dem Sensor zugeführten Chlor. Die obige Abbildung zeigt die "Drei-Elektroden-Konfiguration". Die meisten Membran-Chlorsensoren verwenden die "Zwei-Elektroden-Methode". Im Allgemeinen sind die Messwerte bei der Zwei-Elektroden-Methode nicht so stabil und die Elektroden halten nicht so lange wie bei der Drei-Elektroden-Methode.
Wenn Chlor zu Wasser hinzugefügt wird, hydrolysiert es und bildet: In der Regel handelt es sich dabei um unterchlorige Säure (HOCl), die mit dem amperometrischen Membransensor gemessen wird.
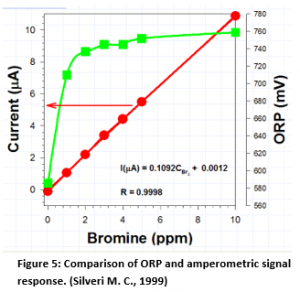
Beziehung zwischen logarithmischen und linearen Signalen
Wie aus Abbildung 5 ersichtlich, ist bei amperometrischen Systemen die Beziehung zu Chlor (oder Brom) linear im Vergleich zu der logarithmischen
Beziehung für ORP. Jeder Versuch, Brom bei 2 bis 4 ppm zu kontrollieren, wird nicht zu einer sehr genauen Kontrolle führen, da die Auflösung in diesem Bereich sehr schlecht ist, wenn Brom das Oxidationsmittel ist.
Zusammenfassung
Die Verwendung des Redoxpotentials zur Messung der Chlorkonzentration unterliegt folgenden Einschränkungen:
- Bei amperometrischen Systemen ist die Beziehung zu Chlor (oder Brom) linear, während sie bei ORP logarithmisch ist. Die ORP-Messung ist nicht präzise, erfordert mehr Schulung und Überwachung und kann zu übermäßiger Korrosion von Bauteilen oder Behältern führen, was oft den Zweck oder die Verwendung von vornherein zunichte macht.
- Amperometrische Systeme messen tatsächlich Brom (TRO) und nicht einen anderen Parameter (Redox) und sind daher genauer.
- Null-Chlor ist immer Null, so dass bei amperometrischen Systemen keine Null-Kalibrierung erforderlich ist.
- Die Elektroden von amperometrischen Systemen werden nicht so leicht durch organische Stoffe vergiftet wie ORP-Elektroden.
- Das ORP ist sowohl ein guter qualitativer Indikator als auch eine schlechte quantitative Methode.
ORP-Schlussfolgerungen
Die Nachteile der ORP-Methode liegen in der routinemäßigen Wartung der Geräte, der Kalibrierung, der Vergiftung der Elektroden, dem Vorhandensein mehrerer Redoxpaare und dem sehr geringen Austauschstrom, der logarithmisch zur Analytkonzentration steht. Mit anderen Worten: Die Annahme eines reversiblen chemischen Gleichgewichts, eine schnelle Elektrodenkinetik und das Fehlen von Störreaktionen sind für die chemische Interpretation der Redoxpotentiale unerlässlich. Leider sind diese Bedingungen in realen Systemen selten, wenn überhaupt, erfüllt (Kissinger, 1996). Das ORP kann für eine qualitative Analyse verwendet werden.
Referenzen:
Battelle. (2004). Long-Term Deployment of Multi-Parameter Water Quality Probes/Sondes. Washington, DC: US Environmental Protection Agency.
Cohrs, D. (2004). Die Eigenschaften und die Zusammensetzung von Meerwasser: Ein "elementarer" Überblick. 1. Internationales Symposium über Wassersysteme in Aquarien und Zoologischen Parks, (S. 23). Lissabon, Portugal.
Damon S. Williams Associates, LLC. (2004). ONLINE-ÜBERWACHUNG DER ABWASSERCHLORUNG UNTER VERWENDUNG DES OXIDATIONS-REDUKTIONS-POTENTIALS (ORP) IM VERGLEICH ZUR RESTCHLORMESSUNG. Alexandria, VA: Stiftung für Wasserumweltforschung WERF.
(1991-1992). "Elektrochemische Reihen" und "Elemente im Meerwasser". In P. David R. Lide, CRC Handbook of Chemistry and Physics 72nd Edition (pp. 8-17; 14-10). New York: CRC Press.
Emerson Process Liquid Division. (2008, Mai Unbekannt). Grundlagen der ORP-Messung. Abgerufen am 28. Februar 2011, von emersonprocess.com: www2.emersonprocess.com/siteadmincenter/.../Liq_ADS_43-014.pdf
Vereinigung für Instrumententests. (1990). Restchlor-Analysatoren für Wasser- und Abwasseraufbereitungsanwendungen. Henderson, NV : Instrument Testing Assocation.
Vereinigung für Instrumentenprüfung. (1995). Online-Analysatoren für den Gesamtchlorgehalt und den freien Chlorrückstand: Benchmarking-Studie zur Wartung. Hendersen, NV: Instrument Testing Association.
Internationale Organisation für Normung. (2003). ISO15839 Wasserqualität - Online-Sensoren/-Analysegeräte für Wasser - Spezifikationen und Leistungsprüfungen. Genf, Schweiz: ISO.
ISO Internationale Normen. (2003). ISO15839 Wasserqualität - Online-Sensoren/Analysengeräte für Wasser - Spezifikationen und Leistungsprüfungen. Genf, Schweiz: ISO.
J, M. (2006). The Chemistry of Gold Extraction, 2. Auflage. Iain House, veröffentlicht von SME.
Kemmer, F. (1988). Nalco Water Handbook, 2. Aufl. New York, NY: McGraw-Hill, Inc.
Kissinger, P. (1996). Laboratory Techniques in Electroanalytical Chemistry2nd Ed. . New York: Marcel Decker.
McPherson, L. (2002, Frühling). Oxidationsreduktionspotential (ORP)-Systeme verstehen. Abgerufen von Walchem Corporation.
Panguluri, S. G. (2009). ÜBERWACHUNG DER WASSERQUALITÄT IM VERTEILUNGSSYSTEM: METHODIK UND ERGEBNISSE DER BEWERTUNG VON SENSORTECHNOLOGIEN. Washington, DC: U.S. ENVIRONMENTAL PROTECTION AGENCY .
Piela, B. P. (2003). Elektrochemisches Verhalten von Chloraminen an rotierenden Platin- und Goldelektroden. Journal of the Electrochemical Society, E255- E265.
SAMA-Standard PMC 31.1. (1980). Generische Testmethoden für die Prüfung und Bewertung von Prozessmess- und -regelinstrumenten. Williamsbury, VA: Measurement Control & Automation Association.
Silveri, M. C. (1999). On-Line 'Reagentless' Amperometric Method for Determination of Bromine in Spas. Proceedings of the 4th Annual Chemistry Symposium National Spa and Pool Institute (S. 37-43). Las Vegas, NV: National Swimming Pool Institute.
Silveri, M. C. (2001, 7. August). Patent Nr. 6270680B1. US.
Der Verband für Mess-, Steuer- und Automatisierungstechnik, 1980. (1980). Allgemeine Prüfverfahren für die Prüfung und Bewertung von Prozessmess- und -regelinstrumenten. The Measurement, Control and Automation Association (Verband für Mess-, Regel- und Automatisierungstechnik).
Wegand, J., Lucas, K., Jackovic, T., & Slebodnick, P. a. (2001). Submarine Biofouling Control- Chlorination DATS Study at Pearl Harbor", Berichtsnummer: A565293. Washington DC: Naval Research Lab.
White, G. C. (1992). The Handbook of Chlorination and Alternative Disinfectants, 3. Auflage. Van Nostrand Reinhold.
Weltgesundheitsorganisation. (2006). Leitlinien für eine sichere Wasserumgebung für Freizeitaktivitäten. Band 2. New York, NY: Weltgesundheitsorganisation.